Топ-модель: как мыши помогают человеку бороться с раком

Разработка эффективного препарата против рака немыслима без исследований на животных, которые помогают не только понять механизмы возникновения и развития онкозаболеваний, но и протестировать новую терапию. Расскажем нюансы такой работы: как выбор места имплантации опухолевых клеток влияет на ход эксперимента, как отслеживать рост метастазов в режиме реального времени и с чего начинается раковая трансформация.
Разобраться в механизмах развития онкологических заболеваний нам помог младший научный сотрудник Научного центра генетики и наук о жизни Университета «Сириус» по направлению «Иммунобиология и биомедицина» Вадим Шиндяпин.
Рак — это «Матрица» без Нео
Рак часто называют болезнью века, хотя он существует столько же, сколько и многоклеточная жизнь: опухоли были даже у динозавров. Но что именно происходит, когда нормальная клетка превращается в раковую? Вадим Шиндяпин проводит сравнение с фильмом «Матрица».
«Нормальные клетки — это послушные элементы системы, которые работают по правилам и отключаются, когда их время приходит. Но иногда появляются отклонения — эдакие Нео (которого мы выкинем из примера ради стройности аллегории) или агент Смит. Тогда клетка выходит из-под контроля, игнорирует сигналы, бесконтрольно копирует себя и пытается захватить всю систему, угрожая её разрушением», — говорит он.
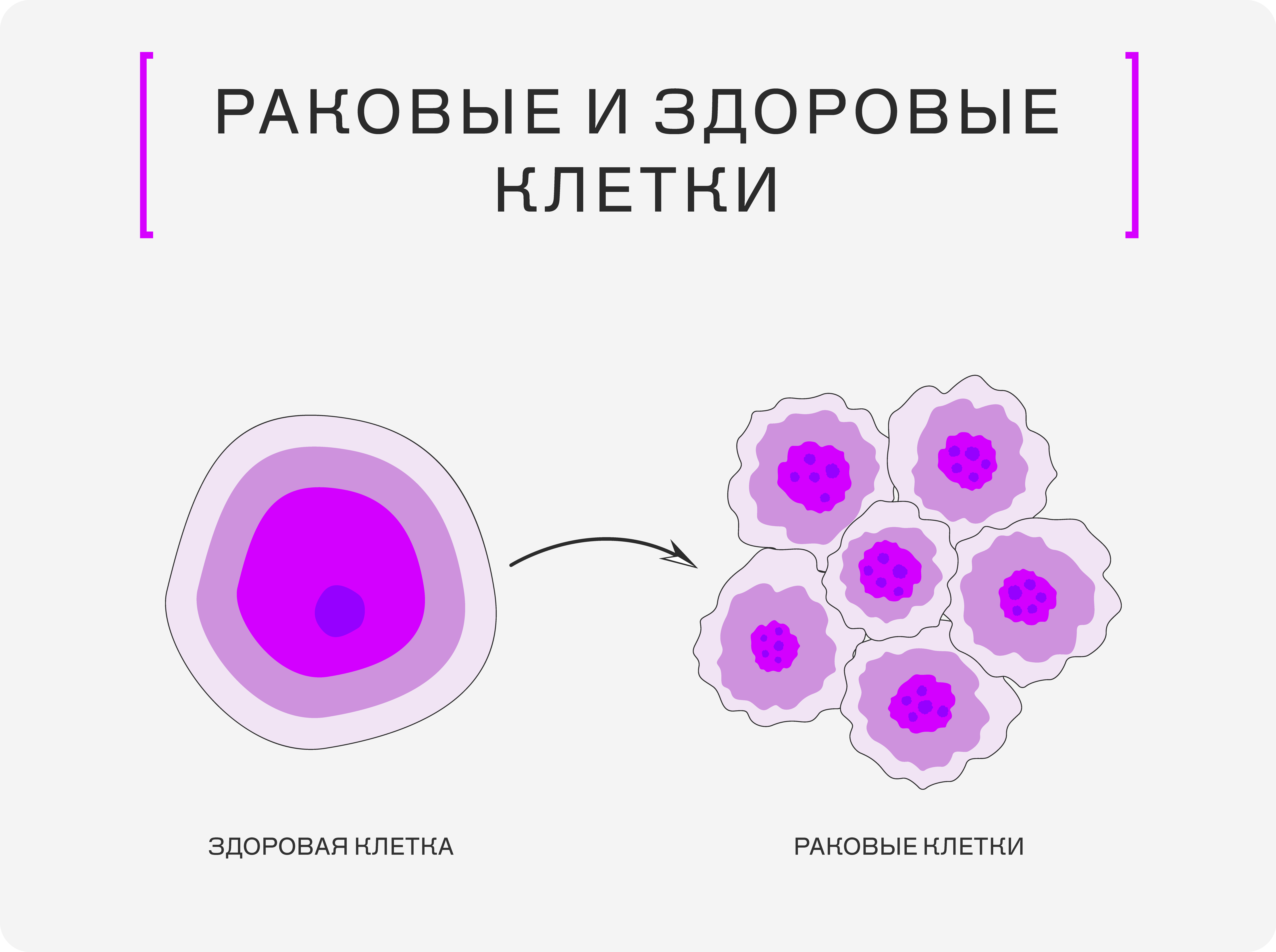 Опухолевые клетки — потомки одной когда-то образовавшейся клетки
Изображение: © Яна Алябьева / «Сириус(Журнал»
Опухолевые клетки — потомки одной когда-то образовавшейся клетки
Изображение: © Яна Алябьева / «Сириус(Журнал»
Раковая трансформация начинается с генетических мутаций — изменений в ДНК клетки. Некоторые мутации могут активировать онкогены или деактивировать гены-супрессоры опухолей, которые обычно сдерживают этот процесс. Для развития рака требуется накопление многочисленных генетических изменений — это многоступенчатый процесс, который может занимать годы и десятилетия. По мере накопления мутаций клетки приобретают так называемые признаки рака:
— способность к бесконечному делению;
— невосприимчивость к сигналам остановки роста;
— уклонение от программируемой клеточной смерти (апоптоза);
— стимуляция образования новых кровеносных сосудов вокруг опухоли (ангиогенез);
— способность к инвазии (прорастанию через ткани);
— метастазирование — особенно опасный аспект рака, когда опухолевые клетки отрываются от первичного очага и колонизируют другие органы.
Раковые клетки имеют ещё множество особенностей, и их признаки не ограничиваются только теми, что мы перечислили выше.
 Традиция использования животных в медицинских исследованиях уходит корнями в Античность — такие эксперименты проводил ещё Аристотель
Фото: © Stivog / Shutterstock / FOTODOM
Традиция использования животных в медицинских исследованиях уходит корнями в Античность — такие эксперименты проводил ещё Аристотель
Фото: © Stivog / Shutterstock / FOTODOM
О братьях наших меньших в онкологии
«Модель — это ложь, которая помогает увидеть правду», — говорил американский онколог Говард Скиппер. Эта фраза как нельзя лучше описывает принцип использования лабораторных животных в экспериментальной онкологии. В первую очередь речь о грызунах — мышах и крысах. Они хорошо адаптируются к условиям в неволе, дают многочисленное потомство и имеют короткий жизненный цикл, что позволяет наблюдать развитие болезни и эффекты лечения в сжатые сроки.

Обитатели лабораторий: главные животные в мире науки
ЧитатьМодели опухолей, которые используются в экспериментальной онкологии
- Спонтанные. Возникают у животных естественным путем — без вмешательства исследователей. Например, у мышей часто развиваются спонтанные опухоли молочной железы. Такие модели наиболее близки к клиническому течению болезни у человека.
- Химически индуцированные. Вызванные введением химических канцерогенов — например, бензпирена. При подкожном введении этого вещества у всех животных в месте инъекции развиваются фибросаркомы.
- Генетически модифицированные (GEMM). Созданные путём направленного изменения генома мышей. Например, существуют линии мышей для изучения колоректального рака, которые помогают учёным изучать мутации гена KRAS, часто встречающиеся у людей с этим заболеванием.
- Перевиваемые. Самая многочисленная группа моделей. Речь идёт о пересадке фрагмента опухоли одного животного другому или о введении культуры опухолевых клеток человека иммунодефицитному животному (ксенографтные модели). В последнем случае используют иммунодефицитных мышей из линий NOD/SCID или NSG, у которых отсутствуют Т-, В-клетки и естественные киллеры. Это позволяет избежать отторжения человеческих клеток.
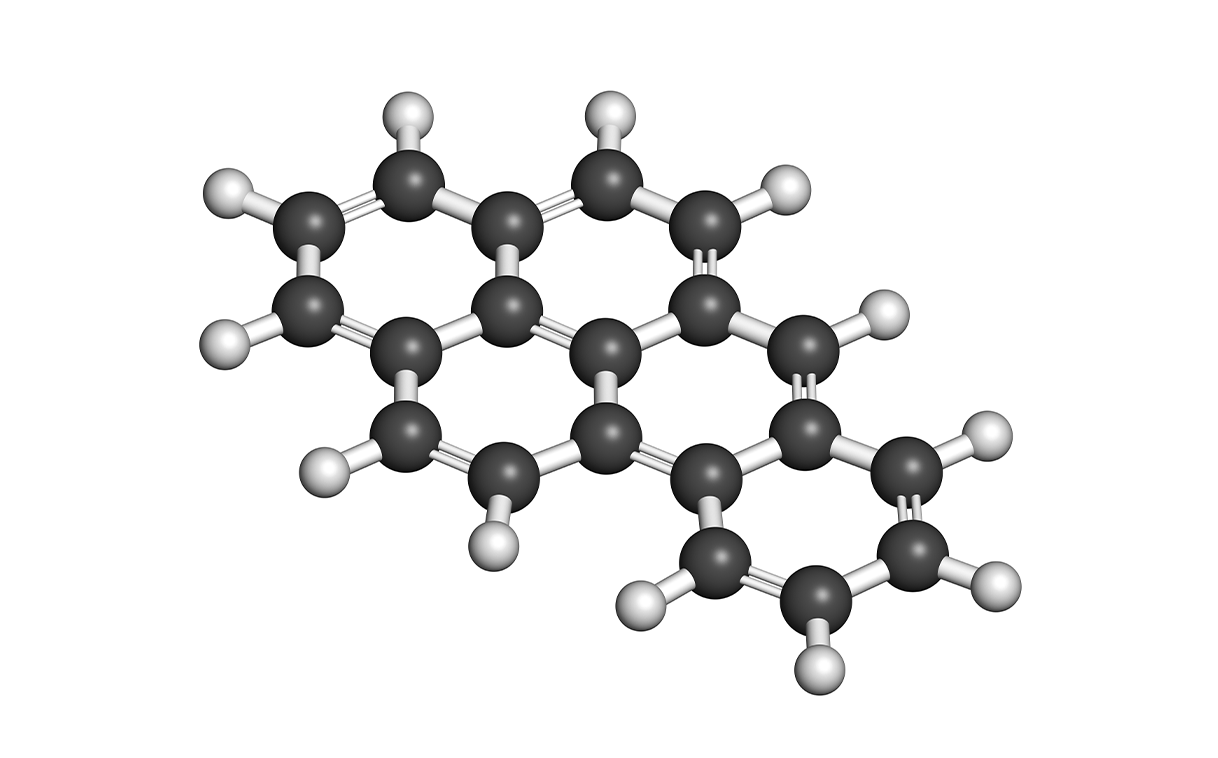 Структурная формула бензпирена (черные — атомы углерода, белые — атомы водорода)
Фото: © StudioMolekuul / Shutterstock / FOTODOM
Структурная формула бензпирена (черные — атомы углерода, белые — атомы водорода)
Фото: © StudioMolekuul / Shutterstock / FOTODOM
От клетки к опухоли: как приживаются и развиваются раковые клетки
Процесс приживления раковых клеток в организме экспериментального животного напоминает колонизацию: «переселенцы» (опухолевые клетки) должны не только выжить на новом месте (в организме животного), но и основать «поселение» (опухоль), которое будет расти и развиваться. В первую очередь успех онкоэкспансии зависит от самих болезнетворных клеток — их жизнеспособности, агрессивности, способности адаптироваться к новому микроокружению. Также важны характеристики организма-хозяина, особенно состояние его иммунной системы.
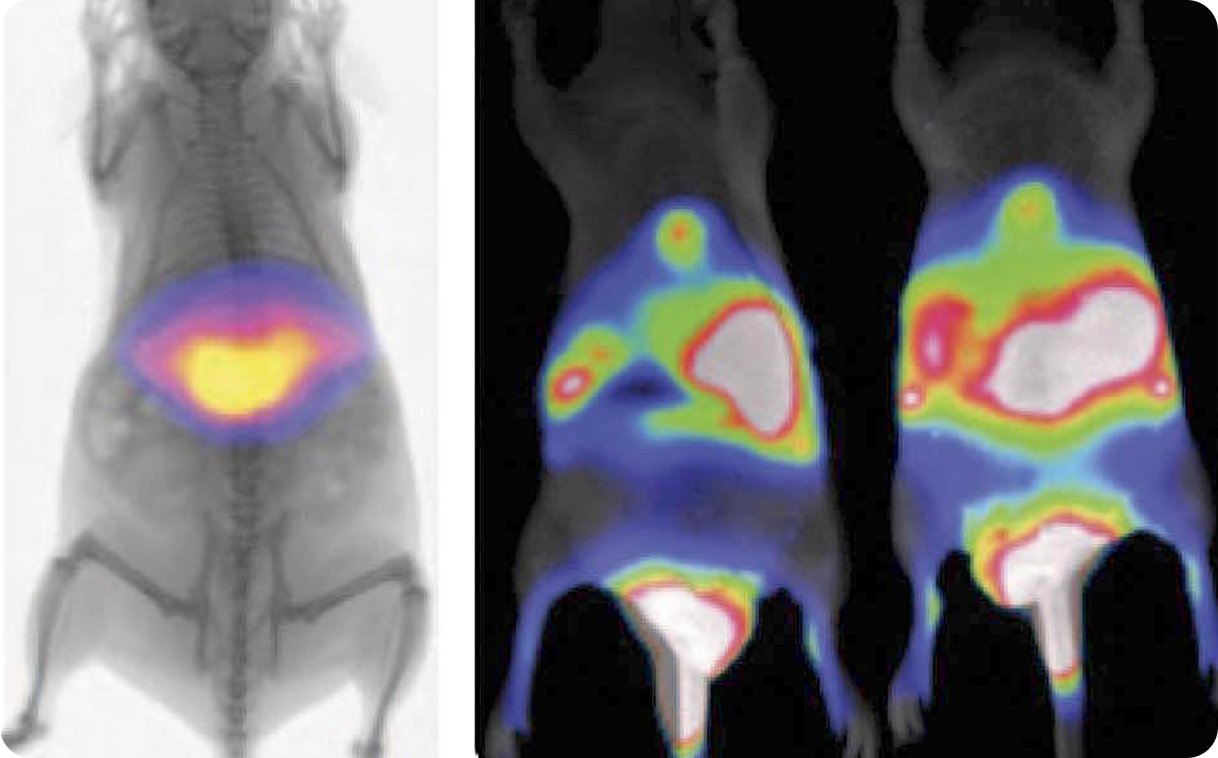
Наблюдать за ростом опухоли можно даже в режиме реального времени, не причиняя при этом боли животному. Для этого используют клеточные линии, экспрессирующие ферменты или белки, которые обеспечивают биолюминесценцию (например, люциферазу) или флюоресценцию (например, GFP). Это позволяет отслеживать развитие опухоли с помощью системы in vivo визуализации, регистрирующей световое или флюоресцентное излучение от опухолевых клеток.
Выбор места имплантации опухолевых клеток напрямую влияет на ход эксперимента. Фактически учёные выбирают «почву», на которой будет расти опухоль. От того, куда именно будет введена опухоль, часто зависит, насколько функциональной в итоге станет модель.
Основные методы имплантации опухолей
- Подкожная. Наиболее простой и распространённый метод, при котором, как нетрудно догадаться из названия, клетки вводятся под кожу (обычно в область спины или одного из боков животного). Эта несложная процедура даёт возможность визуально наблюдать за опухолью и измерять её. Единственный недостаток заключается в том, что микроокружение не соответствует органу происхождения рака.
- Ортотопическая. Введение раковых клеток в орган животного, соответствующий органу происхождения опухоли у человека. Это позволяет воспроизвести естественное микроокружение опухоли и лучше изучать процессы инвазии и метастазирования
- Внутрибрюшинная. Введение клеток в брюшную полость. Часто используется, например, для моделирования перитонеального карциноматоза, характерного для рака яичников.
- Внутривенная. Введение клеток в хвостовую вену мыши для изучения процессов циркуляции опухолевых клеток в кровотоке и формирования отдалённых метастазов.
Спектр онкозаболеваний, исследуемых на животных моделях, чрезвычайно широк: от легко наблюдаемых опухолей вроде рака молочной железы или лёгкого до гемобластозов, которые трудно выявлять, а также редких форм рака. Особое внимание уделяется созданию моделей, которые воспроизводят метастатический процесс, так как именно подобные злокачественные новообразования являются основной причиной смертности от рака.
Мышь — не человек
Но насколько результаты экспериментов на животных применимы для лечения пациентов? Как гласит статистическая шутка, все модели неверны, но некоторые полезны. Хотя организмы человека и мыши во многом похожи, отличий достаточно много. Например, в том, как устроены метаболические пути, определяющие переработку организмом питательных веществ и лекарств. У грызунов обмен веществ в разы выше, что влияет на распределение и выведение препаратов. Значит, расчёты доз, эффективные для мыши, могут оказаться неподходящими для человека (разумеется, в рамках пересчёта на вес).
 Работать с мышами гораздо легче, чем с другими животными, поскольку их клетки легко культивировать
Фото: © Hamara / Shutterstock / FOTODOM
Работать с мышами гораздо легче, чем с другими животными, поскольку их клетки легко культивировать
Фото: © Hamara / Shutterstock / FOTODOM
Кроме того, во время лабораторных экспериментов рак обычно создают искусственно — с помощью химических веществ или генетических манипуляций. Такие опухоли развиваются в контролируемых условиях, и они, как правило, однороднее тех, что годами формируются у человека под воздействием сложного коктейля из генетических мутаций, экологических факторов и особенностей образа жизни.
Различны и иммунные системы. У мышей, которых часто используют в онкологических исследованиях, нет некоторых ключевых элементов человеческого иммунитета. Например, определённых типов Т-, B-клеток, цитокинов и других функциональных элементов иммунитета, критически важных для успеха иммунотерапии (такой как блокада PD-1/PD-L1, например). Так что подход, показавший успех у мышей, нередко оказывается неэффективным в клинических испытаниях.
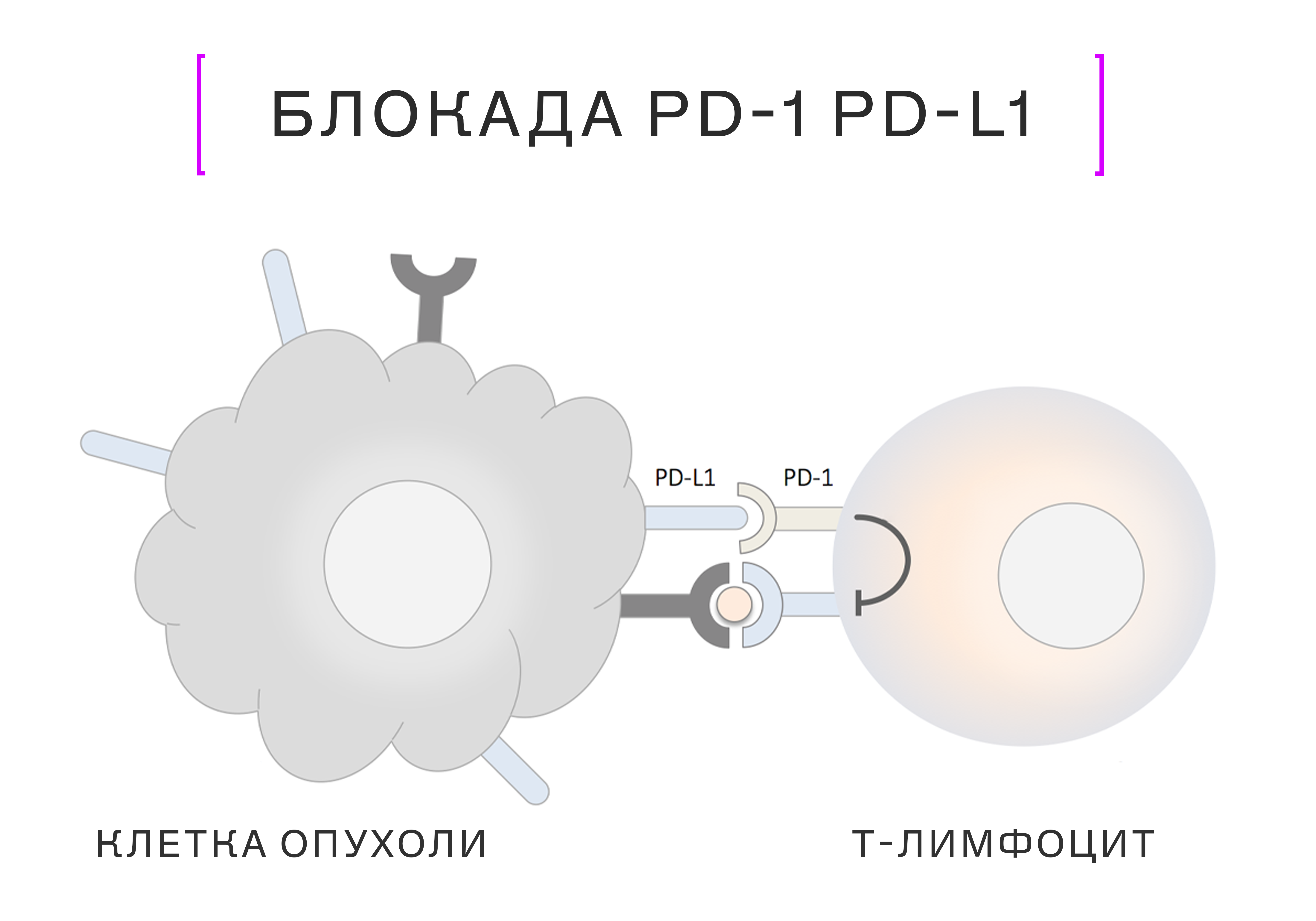 Рецептор PD-1 на Т-лимфоцитах связывается с PD-L1 на опухолевых клетках, подавляя иммунитет и защищая опухоль. Ингибиторы PD-1/PD-L1 блокируют эту связь, возвращая Т-лимфоцитам возможность для борьбы с опухолью
Изображение: © GeneCopoeia
Рецептор PD-1 на Т-лимфоцитах связывается с PD-L1 на опухолевых клетках, подавляя иммунитет и защищая опухоль. Ингибиторы PD-1/PD-L1 блокируют эту связь, возвращая Т-лимфоцитам возможность для борьбы с опухолью
Изображение: © GeneCopoeia
Для повышения трансляционной ценности исследований разрабатываются всё более совершенные модели. Например, гуманизированные мыши, которым пересаживают компоненты иммунной системы человека, помогают тестировать иммунотерапевтические подходы. Благодаря им можно точно предсказывать положительный клинический ответ на лечение у 90 % пациентов и резистентность к проводимой терапии у 97 % больных.
Вопрос этики
Один из главных вопросов в случае с лабораторными животными — как найти баланс между научным прогрессом и гуманным отношением к братьям меньшим. Международные стандарты в области использования живых существ в исследованиях основаны на принципе «трёх R»:
— replacement — использование альтернативных моделей (клеточных культур, компьютерного моделирования, органоидов) везде, где это возможно;
— reduction — снижение количества животных, необходимых для получения статистически значимых результатов;
— refinement — модификация экспериментальных процедур для минимизации боли и страданий животных.
 Работа с животными моделями в онкологии неразрывно связана с этическими вопросами
Фото: © Damira / Shutterstock / FOTODOM
Работа с животными моделями в онкологии неразрывно связана с этическими вопросами
Фото: © Damira / Shutterstock / FOTODOM
В России, как и во многих странах, исследования на животных регулируются законодательством. Все эксперименты должны быть одобрены этическим комитетом, а исследователи обязаны соблюдать правила гуманного обращения с подопытными. Это и адекватное обезболивание при болезненных процедурах, и обеспечение комфортных условий содержания. Важно понимать, что этичное обращение с животными — не только моральный императив, но и научная необходимость. Ведь стресс и дискомфорт могут влиять на физиологические параметры, искажая результаты исследований.
Несмотря на развитие метода in silico и распространение искусственного интеллекта, исследования на животных продолжают играть ключевую роль в понимании механизмов развития рака и разработке новых методов лечения. Даже с учётом всех ограничений они остаются незаменимым звеном между лабораторными экспериментами in vitro и клиническими испытаниями с участием людей. Современные технологии позволяют создавать всё более совершенные модели, всё точнее имитирующие заболевания человека и открывающие новые возможности для трансляционных исследований и персонализированной медицины. Да, любая модель — это упрощение, но она позволяет учёным приблизиться к всестороннему пониманию природы рака и путей его лечения. А лабораторная мышь остаётся одним из главных союзников человечества в борьбе против болезни века.