Екатерина Минская — об успехе в лечении рака, игре в бога и чудо-стипендии

Она могла стать музыкантом, но пошла в науку. Молекулярный биолог Екатерина Минская занималась исследованиями в Англии, Шотландии, Северной Ирландии, Германии, Португалии, а теперь передаёт знания молодым учёным в Университете «Сириус». Мы расспросили её об учебе и работе за рубежом, обучении студентов и прорывных разработках.
Мы продолжаем серию интервью с российскими учёными, у которых накоплен опыт работы за рубежом, у многих — весьма солидный. Им есть с чем сравнивать, поэтому говорим с ними не только о профильных исследованиях, но и о том, как развивается наука в России и других странах.
— Екатерина Сергеевна, как вы пришли в науку?
— Никакой науки вообще не должно было быть (улыбается). Я очень люблю играть на пианино. Мне было около пяти лет, когда меня отдали в музыкальную школу Владивостока, и я была первой ученицей у лучшего педагога. В 13 лет должна была ехать в петербургскую консерваторию, куда меня приняли. Но там нужно было жить в общежитии, из-за чего родители переживали. В итоге я не поехала, хоть и продолжила играть.
Позже в Шотландии, обучаясь в аспирантуре, я подрабатывала репетитором — учила детей игре на фортепиано. Один из моих воспитанников стал настоящим музыкантом. Я даже купила хорошее цифровое пианино и возила его с собой — от Белфаста до Лондона.
К сожалению, перевезти пианино в Россию оказалось невозможно, и я решила подарить его дому престарелых
Хотя сейчас у меня нет возможности играть, музыка остаётся важной частью моей жизни. Я регулярно посещаю концерты, которые проходят в Университете «Сириус», очень люблю джаз.
А в науку пришла благодаря маме — она всю жизнь проработала в этой области. Я провела детство у неё в лабораториях.
Кто такая Екатерина Минская?
Екатерина Минская — главный научный сотрудник направления «Генная терапия» Научного центра трансляционной медицины Университета «Сириус». Преподаватель молекулярной биологии, кандидат наук (PhD). Опыт работы — более 20 лет. Училась в Дальневосточном государственном университете (ДВГУ), Central European University (CEU) , University of Glasgow.
Работала в Wuerzburg University (Германия), Queen’s University Belfast (Северная Ирландия), University of St Andrews (Шотландия), Edinburgh University (Шотландия), University College London (Англия), Lisbon University (Португалия). Соавтор многочисленных научных публикаций в журналах PNAS, Frontiers in Immunology, Stem Cell.
— А как вы оказались за рубежом?
— Я училась в Дальневосточном государственном университете и на пятом курсе во время написания диплома первый раз поехала за границу. По программе культурного обмена я прожила три месяца в Сан-Франциско. Мой колледж находился в Окленде. Там были очень дружелюбные люди, огромное количество студентов со всего мира.
Я жила в американской семье, где у меня была замечательная «мама». По программе, она должна была кормить меня завтраком и ужином, но я весь день проводила в колледже и возвращалась поздно. Поэтому она давала мне пакеты с едой на целый день. Её домашняя кухня была настолько вкусной, что я набрала около 5 кг. А чтобы поздно вечером я не возвращалась пешком одна, забирала меня на машине.
Зная мою любовь к музыке, она на Новый год подарила мне билет в оперный театр Сан-Франциско на мюзикл «Призрак оперы». Наши места находились прямо в центре зала, где падает знаменитая люстра. Казалось, она пролетает буквально над головами. Впечатления от этого спектакля остались незабываемыми. С тех пор обожаю эту постановку и стараюсь ходить на неё везде, куда бы ни приехала.
После Сан-Франциско я написала дипломную работу, окончила ДВГУ и получила scholarship на магистерскую программу в Central European University в Будапеште.
 Центрально-Европейский университет в Будапеште. Здесь учатся больше 1 500 студентов из 100 стран
Фото: © EQRoy / Shutterstock / FOTODOM
Центрально-Европейский университет в Будапеште. Здесь учатся больше 1 500 студентов из 100 стран
Фото: © EQRoy / Shutterstock / FOTODOM
Учиться там было невероятно сложно, потому что двухгодичная магистерская программа рассчитана на год. Обучение на английском языке. Пусть и говоришь свободно, но чтобы сдать экзамен, нужно по три раза все перечитать, запомнить, записать. Я вставала в четыре утра весь год, как и на первом курсе университета, занималась три часа в тишине, потом завтракала и ехала на учебу.
После магистерской программы я подала несколько заявок в университеты США, и в трёх из них мне дали стипендии. Но только на обучение, а на проживание квоты не было. И в самый последний момент мне предложили стипендии сразу в двух аспирантурах в Великобритании.
Такую возможность предоставляли трём лучшим студентам нашего факультета Центрально-Европейского Университета, и я оказалась среди них
Одна из квот была в Манчестер, где предлагалось заниматься бактериологией. А вторая — в Глазго, в University of Glasgow. Там была ведущая лаборатория в мире под руководством моего любимого руководителя профессора Ричарда Эллиотта. Там занимались геморрагическими лихорадками. По ним был мой диплом в ДВГУ, так что я решила идти туда.
 Университет Глазго — четвёртый по старшинству в Великобритании и крупнейший университет в Шотландии, основан в 1451 году
Фото: © Kevin Manion / Shutterstock / FOTODOM
Университет Глазго — четвёртый по старшинству в Великобритании и крупнейший университет в Шотландии, основан в 1451 году
Фото: © Kevin Manion / Shutterstock / FOTODOM
При этом разница в оплате за обучение в аспирантуре для граждан Великобритании и иностранцев была примерно 10–12 тысяч фунтов в год. Так что мне нужно было найти эту сумму. И случилось чудо! Впервые в истории этого университета декан факультета медицины согласился за первый год не брать эту разницу с условием, что на второй и третий год я получу престижную стипендию (ORS). Я думала, это невозможно, ведь её предоставляет правительственная организация — Британский совет, но в итоге получила её.
— В чем особенности научных коллективов за рубежом?
— В Великобритании сотрудники научных лабораторий каждую пятницу обязательно выбираются куда-то, чтобы лучше узнать друг друга в неформальной обстановке. Наш паб в Глазго находился через дорогу от института, и туда приходили сотрудники разных лабораторий. Это были и заведующие, и аспиранты, и магистранты, и научные сотрудники. После таких встреч уже не было чёткой иерархии, когда один выше другого. А в сплочённом коллективе, в дружественной и доброжелательной обстановке проекты делаются с большей эффективностью. Когда в лаборатории приятная атмосфера, люди друг другу помогают, нет нездорового соперничества. Конкурируешь лишь с самим собой.
За границей люди работают много, интенсивно и эффективно. Если во время эксперимента у меня появилось три свободных минуты, я в это время занимаюсь чем-то полезным. Соответственно, в день делаешь в 10 раз больше, чем если бы выполнял задачи не параллельно, а последовательно. В Университете «Сириус» я пытаюсь учить этому своих студентов.
 «У шотландцев уникальный акцент, у меня ушла целая неделя на то, чтобы научиться их понимать», — вспоминает Екатерина Минская
Фото: © Kamira / Shutterstock / FOTODOM
«У шотландцев уникальный акцент, у меня ушла целая неделя на то, чтобы научиться их понимать», — вспоминает Екатерина Минская
Фото: © Kamira / Shutterstock / FOTODOM
— Над какими проектами вы работали в Европе?
— В University of St Andrews в Шотландии я занималась оптимизацией условий ко-экспрессии белков для биомедицинских исследований и генной терапии в лаборатории ещё одного моего любимого руководителя — профессора Мартина Райана (Martin D. Ryan). Этот подход широко используется учёными во всем мире. В Германии, где потом оказалась, изучала коронавирус SARS-CoV-1. Затем вся команда с исследованиями переехала в Белфаст, столицу Северной Ирландии, где продолжили изучать SARS.
Потом я на три года перебралась в Португалию, о чём хочу рассказать подробнее. Там в Instituto de Medicina Molecular велись клинические исследования по пересадке костного мозга пациентам с острым миелоидным лейкозом. Необходимо было исследовать иммунные клетки, способные подавлять нежелательные реакции, связанные с отторжением трансплантата. В одних случаях они могли подавлять иммунный ответ, а в других — нет. В итоге мы обнаружили, что один из молекулярных маркеров, широко использующийся в лабораториях и больницах для оценки активности этих клеток, имел определённые ограничения. Ранее опубликованные данные о нём были неполными, а наши выводы поставили под сомнение корректность данных десятков научных статей, которые я проанализировала.
 На конференции American Society of Hematology в Атланте (США) с профессором Жуаном Ласерда и коллегой-соавтором Ритой Азеведо
Фото: © из личного архива Екатерины Минской
На конференции American Society of Hematology в Атланте (США) с профессором Жуаном Ласерда и коллегой-соавтором Ритой Азеведо
Фото: © из личного архива Екатерины Минской
После всех этих проектов я переехала в Лондон и проработала три года в University College London (UCL). Там мы занимались пациентами с врождённым иммунодефицитом, изучали причины заболевания и искали генотерапевтические подходы к их лечению.
— А потом началась пандемия COVID-19, которая изменила вашу жизнь…
— Да. Накануне пандемии у меня внезапно умер папа, и я не смогла приехать с ним попрощаться. А у мамы очень плохое здоровье. В последние годы я специально жила в Лондоне, чтобы в любую секунду можно было сесть в самолёт и прилететь в Москву. Но из-за коронавируса рейсы стали отменять один за другим. В течение года у меня было шесть отменённых рейсов.
В итоге я приехала в Россию как раз на первой волне дельта-варианта ковида, и мы все заболели. Пока я была здесь две недели, мама и брат чуть не умерли. У обоих был сложный дельта-штамм. Я сама была с температурой 38 °C, но чувствовала себя лучше остальных, поэтому лечила их. После того как выкарабкались, у всех были ещё долгие осложнения — продолжительностью девять месяцев. Через две недели я вернулась в Лондон — и меня провакцинировали, поскольку наша лаборатория находилась через стенку с больничным отделением с умирающими от ковида больными.
Туда привозили тяжёлых больных в «скафандрах». Очень многие умирали, было страшно
Когда пандемия пошла на спад, появилась надежда, что всё будет как прежде. Но случилась СВО, обрубили все банковские операции, все рейсы приостановили — и снова возник страх, что я не смогу вернуться к родным. Ситуация шла к тому, что границы могли вообще закрыть.
Когда обсуждали с мамой моё возвращение, она рассказала, что видела передачу про Сириус. Предложила попробовать свои силы в созданном здесь Университете новой формации.
 Екатерина Минская в Университете «Сириус» разрабатывает методы лечения наследственных и онкологических заболеваний
Фото: © Ярослав Яровой / Медиадом «Сириус»
Екатерина Минская в Университете «Сириус» разрабатывает методы лечения наследственных и онкологических заболеваний
Фото: © Ярослав Яровой / Медиадом «Сириус»
— Так вы оказались в Университете «Сириус». Какими были первые впечатления?
— Мне очень понравилось — великолепные условия для работы, прекрасная команда, важные и интересные исследования. Университет «Сириус» выделяется своей открытостью и отсутствием жёсткой иерархической структуры, присущей многим академическим учреждениям. Здесь царит атмосфера, напоминающая мне зарубежные лаборатории, в которых я работала.
Одно из главных преимуществ — превосходное техническое оснащение, что открывает широкие возможности для проведения передовых исследований. Ещё одна сильная сторона — акцент на трансляционную медицину, что особенно ценно для меня. Здесь главной задачей ставится создание лекарств. Хотя это накладывает определённый стресс из-за высоких стандартов и требований скорости разработки, но в этом и преимущество — такой подход стимулирует инновации и способствует быстрому внедрению научных достижений в практическое здравоохранение.
— Над чем вы сейчас работаете?
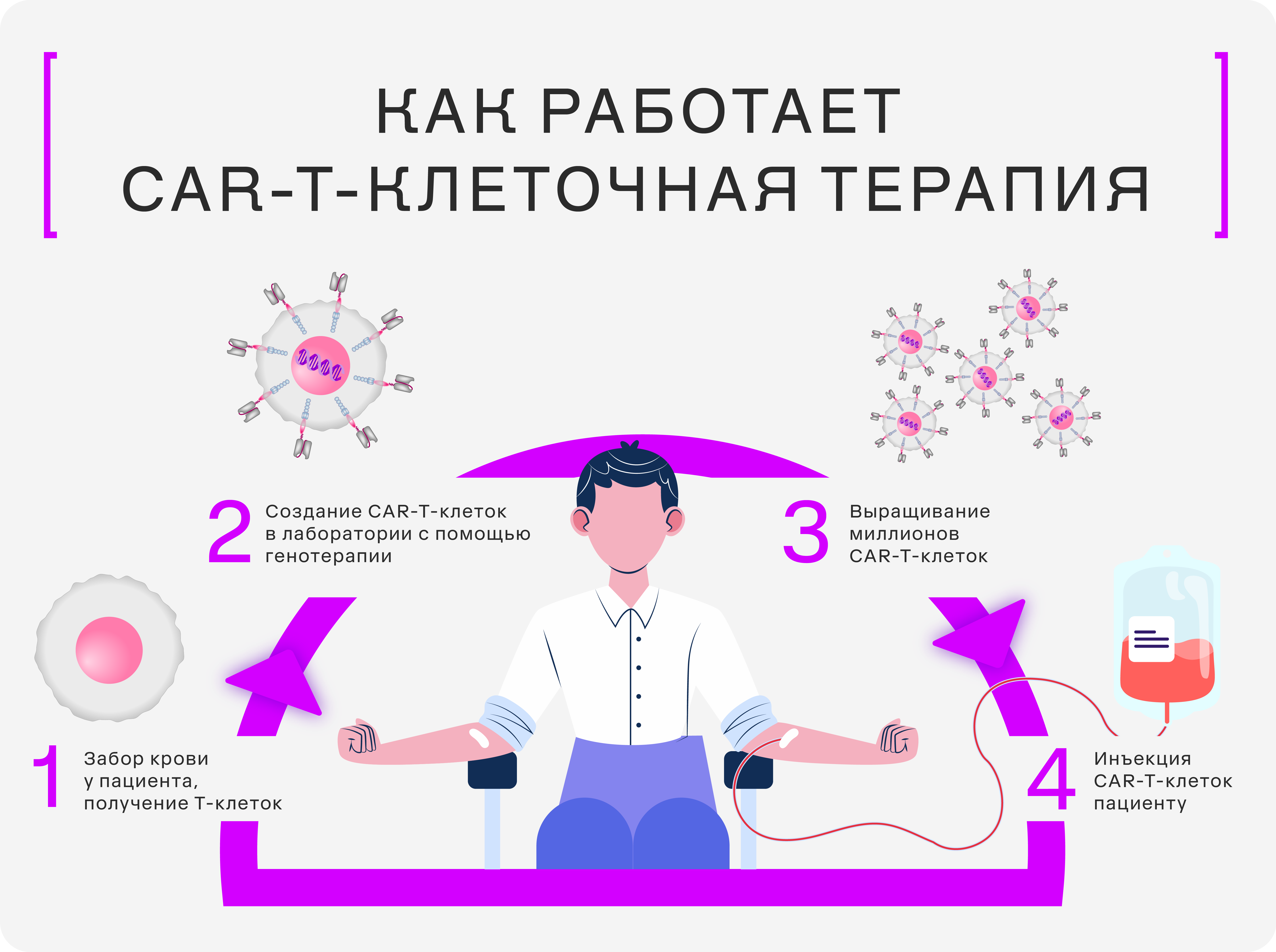
— У нашей команды два основных направления исследований. Первое — генозаместительная терапия для лечения наследственных заболеваний. В основном, сейчас мы фокусируемся на генетически-обусловленных ретинопатиях и на гемофилии. Это те заболевания, которые наследуются в связи с мутациями и не лечатся (или лечение неэффективно, либо длится всю жизнь). Мы предлагаем лечение наследственных заболеваний методом генной заместительной терапии с использованием рекомбинантных аденоассоциированных вирусов. То есть путем доставки здорового гена взамен больного.
Другое направление связано с лечением рака. Сейчас мы разрабатываем два подхода к терапии. Первый основан на использовании рекомбинантных вирусов, которые избирательно воздействуют только на раковые клетки, минуя здоровые ткани. Такой метод предпочтительнее традиционной химио- и радиотерапии, так как он обладает целенаправленным действием и вызывает меньше побочных эффектов.
Мы повышаем эффективность этих вирусов, модифицируя их таким образом, чтобы они доставляли дополнительные иммуностимулирующие факторы, которые заставляют организм пациента активнее бороться с раковыми клетками.
Второй подход — CAR-Т-клетки — модифицированные Т-лимфоциты, которые атакуют и уничтожают больные раковые клетки. Мы меняем их так, чтобы они могли точно распознавать и нацеливаться на опухолевые клетки, используя рецепторы на их поверхности.
Ещё один из моих аспирантов занимается мезенхимальными и индуцированными плюрипотентными стволовыми клетками, которые используются не только в регенеративной медицине, но и применяются для моделирования заболеваний in vitro, а также для тестирования новых лекарств, включая генно-терапевтические вирусы. Я занималась этим направлением в Эдинбурге и сейчас передаю опыт.
— Можно уже говорить о каких-то результатах?
— Нам ещё предстоит провести доклинические испытания, но уже есть отличные результаты. Вместе с моей аспиранткой мы опубликовали первую статью, где показали, что использование нашего рекомбинантного вируса привело к уменьшению размера опухоли на 52 %.
В последнем исследовании мы добились ещё большего успеха — уменьшения опухоли на 75–80 %
Это отличный результат, которого мы достигли благодаря сочетанию двух подходов: использования онколитического вируса и технологии доставки мРНК. Комбинированный метод показал высокую эффективность.
 До того как вернуться в Россию, Екатерина Минская подготовила 22 бакалавра и магистра; в Университете «Сириус» у неё три аспиранта и пять магистров
Фото: © Алёна Енченко / Медиадом «Сириус»
До того как вернуться в Россию, Екатерина Минская подготовила 22 бакалавра и магистра; в Университете «Сириус» у неё три аспиранта и пять магистров
Фото: © Алёна Енченко / Медиадом «Сириус»
— Какие ключевые вызовы сейчас стоят в области молекулярной биологии?
— Всё те же, что и всегда. Чем больше мы знаем и понимаем, тем больше открывается работы для учёных. Если вернуться к тем же наследственным заболеваниям, есть патогенные и непатогенные мутации. А есть те, что под вопросом — патогенные они или нет. А многие до сих пор вообще неизвестны. Каждую из них нужно исследовать.
То же самое с раковыми исследованиями. Происходит огромное количество открытий, которые помогают развивать лекарства. И по-прежнему существуют огромные «серые» области. Например, в области раковых заболеваний есть серьёзная проблема возникновения устойчивости опухолей к терапии. По этой причине умирают 90 % пациентов. Нужно понять, почему возникает эта резистентность. А она индивидуальна: зависит и от типа онкозаболевания, и от самого пациента. Сколько людей, типов рака, географических областей, типов питания, столько и вызовов сегодня существует.
— Есть мнение, что генетики вмешиваются в природу и «играют в бога». Что думаете по этому поводу?
— Любая терапия — это вмешательство. В том числе обычные таблетки, антибиотики. Почему люди тогда их принимают? Получается, те, кто ходит в аптеку, «играют в бога»? Вместо того чтобы медитировать и ждать, когда головная боль пройдёт сама (я, кстати, за медитацию), или когда пневмония может их убить.
 Аспирин — первое лекарство в мире, созданное по технологии массового фармацевтического производства
Фото: © Pormezz / Shutterstock / FOTODOM
Аспирин — первое лекарство в мире, созданное по технологии массового фармацевтического производства
Фото: © Pormezz / Shutterstock / FOTODOM
Та же гемофилия требует пожизненного дорогостоящего лечения, без которого пациент быстро погибнет. Мы разрабатываем генозаместительную терапию, чтобы доставить в организм человека недостающий фактор свёртывания крови и избавить его от необходимости постоянно пить лекарства. Это позволит спасти жизнь пациенту и избавить от огромного эмоционального и финансового стресса его родных. Не думаю, что это «игра в бога».
— Вы много работаете с молодёжью. Нужно ли ей активнее идти в науку?
— Совершенно необходимо. Разработка российских лекарств жизненно важна для нашей страны, учитывая текущие задачи импортозамещения и необходимость обеспечения качественного медицинского обслуживания на огромной территории. Но это важно и в глобальном плане, особенно для стран с ограниченными ресурсами. Если мы сможем создать конкурентоспособные препараты, которые будут доступнее зарубежных аналогов, это принесёт огромную пользу многим государствам, особенно развивающимся. В России можно делать качественные лекарства. Для этого есть все: профессионалы, оборудование, деньги на исследования, а главное — желание.

Дмитрий Иванов: о жидких имплантах, саббатикалах и парадоксальности мышления
Читать