Главные тренды биоинформатики

Биоинформатика стала неотъемлемой частью современной медицины и биотехнологий. Расскажем, в каких её перспективных направлениях могут быть прорывы в ближайшие годы.
Предсказание структуры белков
Одной из самых сложных задач для себя молекулярные биологи долгое время считали предсказание трёхмерной структуры белка по его аминокислотной последовательности. Белки — рабочие лошадки клетки, которые выполняют множество функций, и их структура определяет, как они взаимодействуют с другими молекулами.
 Миллиарды уникальных белков могут быть составлены из вариаций последовательности 20 разных аминокислот
Фото: © ibreakstock / Shutterstock / FOTODOM
Миллиарды уникальных белков могут быть составлены из вариаций последовательности 20 разных аминокислот
Фото: © ibreakstock / Shutterstock / FOTODOM
В 2020 году компания DeepMind представила AlphaFold — программу на базе искусственного интеллекта, которая существенно повысила точность предсказания белковых структур, причём даже тех, которые не встречаются в природе. Эта технология оказала колоссальное влияние на биоинформатику, сделав подобные прогнозы доступными исследователям по всему миру.
За разработку в области вычислительного проектирования и прогнозирования структуры белка в 2024 году вручили Нобелевскую премию по химию. Это событие подробно обсудили вице-президент по ранней разработке и исследованиям компании BIOCAD Павел Яковлев, старший научный сотрудник Института биоорганической химии РАН Антон Чугунов и директор Департамента научного развития BIOCAD Анна Владимирова.
Ещё несколько лет назад в отношении белкового дизайна было много скепсиса. Но сейчас он на коне, и нас, безусловно, ждут прорывы
Павел Яковлев
Возможность предсказания белковых структур уже применяется в разработке лекарств, биоматериалов и ферментов. Такие технологии ускоряют разработку препаратов от тяжёлых патологий, позволяют находить новые вещества для биотехнологических процессов и способствуют расширению знаний о молекулярных механизмах болезней. Несмотря на успехи AlphaFold, исследователи продолжают совершенствовать этот подход. Будущие алгоритмы смогут учитывать молекулярную динамику белков, предсказывать редкие конформации и анализировать большие белковые комплексы.
«Существующие инструменты — только первые ростки, но они уже подчёркивают важность области, которая в ближайшие годы будет развиваться. Пока рано говорить о том, что мы можем на достойном уровне предсказывать структуру всех белков, но отдельные их семейства изучены хорошо, с ними можно продуктивно работать», — рассказывает Павел Яковлев.
мРНК-вакцины
Появление COVID-19 привело к прорыву в области противовирусных препаратов, и одно из наиболее значимых достижений — использование мРНК-вакцин. Эта технология раньше не имела широкого применения, но во время пандемии получила толчок в развитии и сейчас продолжает набирать обороты. В отличие от традиционных вакцин, которые используют ослабленные или убитые вирусы, новый подход подразумевает введение в организм последовательности мРНК, которая кодирует белок, характерный для вируса. Этот белок стимулирует иммунный ответ, не вызывая заболевания, но обеспечивая защиту от возможной инфекции.
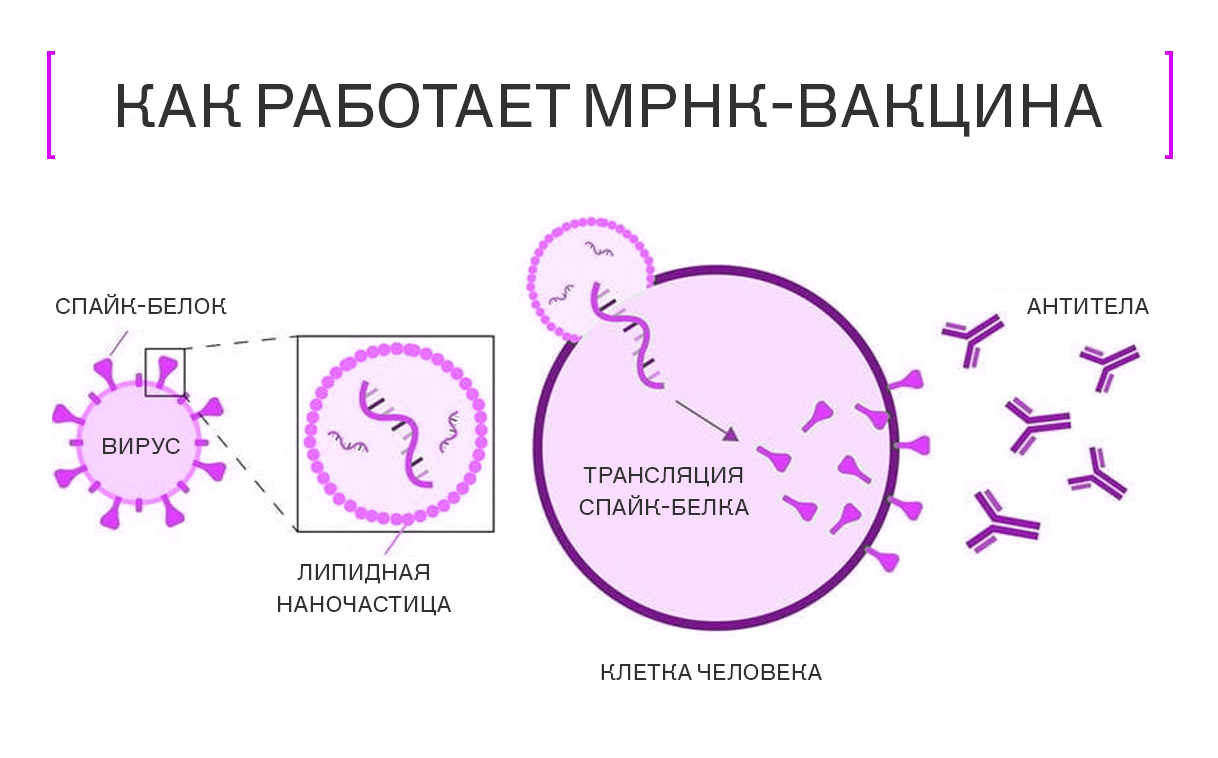 Для доставки мРНК к клеткам используют липидные наночастицы
Изображение: © Яна Алябьева / «Сириус(Журнал»
Для доставки мРНК к клеткам используют липидные наночастицы
Изображение: © Яна Алябьева / «Сириус(Журнал»
Биоинформатика сыграла ключевую роль в разработке мРНК-вакцин. С помощью продвинутых компьютерных программ и мощных вычислительных систем учёные смогли оптимизировать последовательности мРНК, чтобы те вызывали необходимый иммунный отклик. Биоинформатические алгоритмы также помогли в выборе наиболее подходящего белка для вакцины — всё благодаря анализу геномов вирусов и предсказанию того, какие участки их белков, вероятнее всего, будут эффективно распознаны иммунной системой.
Перспективы мРНК-вакцин выходят за рамки борьбы с COVID-19. Ожидается, что эта технология может быть адаптирована для разработки препаратов против других инфекций. Так, в Научно-технологическом университете «Сириус» на базе мРНК синтезируют вакцину от туберкулёза. А ещё такой подход способен победить рак — над созданием подобных вакцин также трудятся российские учёные.

Современное лечение туберкулеза: почему болезнь не удается победить
Читать«Персонифицированные мРНК-вакцины для сложных типов онкологии — очень перспективное направление. Это та область, которая сейчас будет быстро развиваться. Но главная проблема таких вакцин как раз в том, что они персонифицированные, то есть это не какое-то универсальное лекарство для всех, а разработанный под опухоль конкретного пациента препарат. Чтобы этот подход стал массовым, нужно привлечь значительное количество биоинформатиков, чтобы радикально сократить путь от взятия биопсии у пациента до создания мРНК-вакцины для него», — поясняет Павел Яковлев.
Генная терапия
Одна из основных проблем в случае редких генетических патологий — диагностика. На неё могут уйти годы, что изнуряет как самого больного, так и его семью, а ещё отягощает систему здравоохранения. Таким образом, перспективным направлением биоинформатики становится разработка методов раннего выявления генетических заболеваний, чтобы оперативно подобрать стратегию для поддержания пациента.
«Так или иначе потребность в развитии технологий, которые позволяют как можно раньше выявить риски генетических заболеваний у следующих поколений, определяет направление, которое, вероятнее всего, станет трендом в ближайшие годы», — отмечает Павел Яковлев.
Другим, более сложным с точки зрения науки направлением становится разработка генной терапии для лечения подобных болезней. Такой подход позволяет исправлять дефекты в ДНК на уровне отдельных клеток, что даёт шанс на излечение наследственных недугов и на улучшение методов лечения рака. Генную терапию проводят ex vivo, когда модифицируют клетки вне организма, и in vivo, когда систему для редактирования ДНК вводят в непосредственной близости от целевых тканей или органов. Второй метод в последние годы применяется активнее.
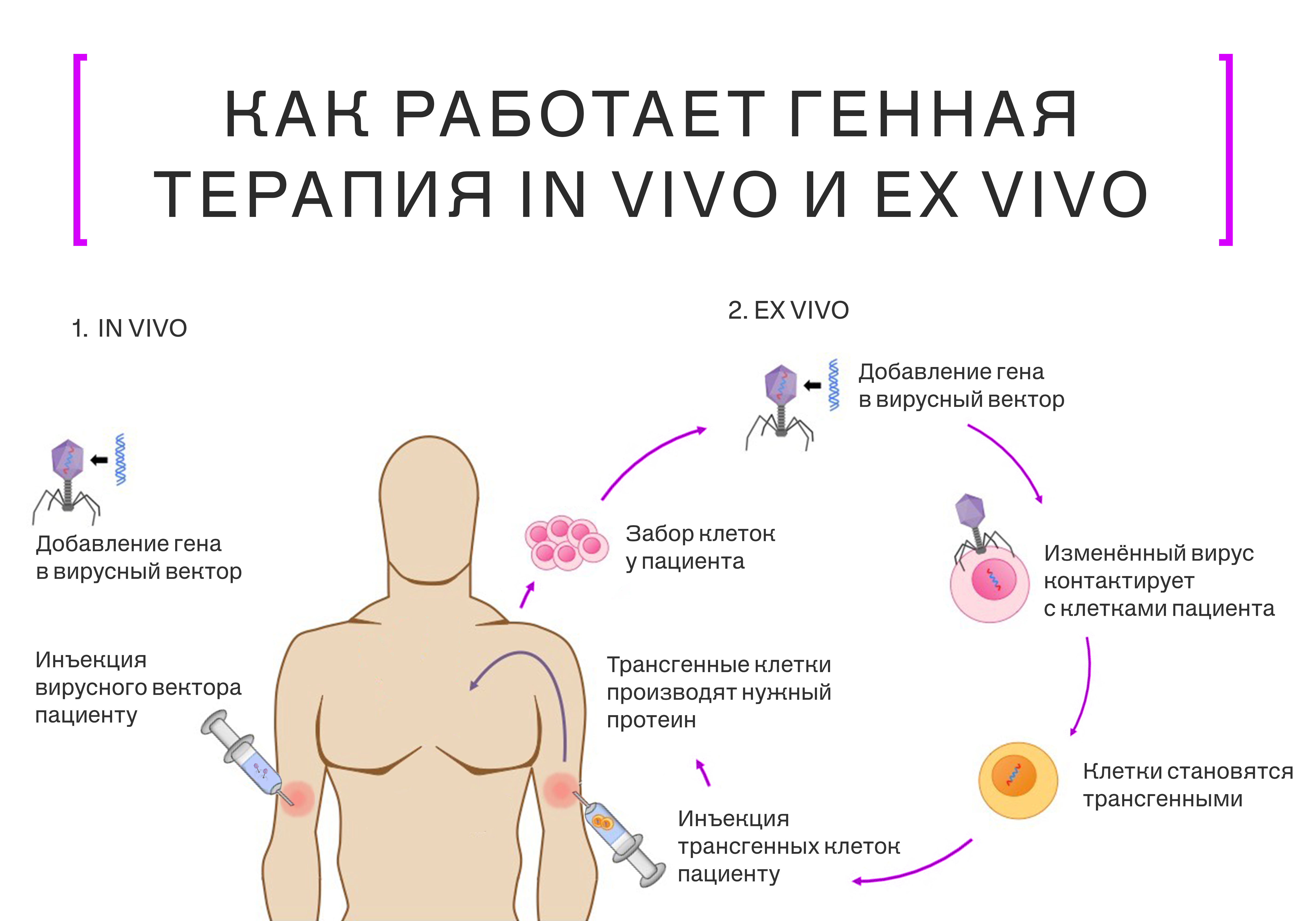 Генная терапия борется с первопричиной заболевания — поломкой на молекулярном уровне
Изображение: © Яна Алябьева / «Сириус(Журнал»
Генная терапия борется с первопричиной заболевания — поломкой на молекулярном уровне
Изображение: © Яна Алябьева / «Сириус(Журнал»
Здесь биоинформатика используется для анализа данных геномных секвенирований, прогнозирования эффекта редактирования ДНК и мониторинга долгосрочных последствий для пациента. Сегодня генная терапия, за редкими исключениями, ещё далека от применения. Одна из главных причин — дороговизна. Разработка подобного препарата обычно очень затратна, а его итоговая цена непосильна для нуждающегося в терапии человека. Другая причина — сложность оценки долгосрочного действия таких лекарств.
Мультиомиксные технологии
Долгое время ученые работали с каждым типом биологических данных отдельно, будь то геном, протеом или метаболом. Однако появление новых подходов к анализу и увеличение вычислительных мощностей компьютеров позволило объединить эти данные для анализа.
Так появились мультиомиксные технологии, которые теперь используют в большинстве исследовательских лабораторий для изучения рака, нейродегенеративных заболеваний, а также для разработки персонализированных методов лечения. Например, анализируя не только генетические мутации, но и изменения в метаболизме или эпигенетических маркерах, можно предсказать, как конкретный пациент отреагирует на лечение, что позволит подобрать наиболее эффективную терапию. Также эти подходы позволяют находить биомаркеры, которые не могут быть выявлены только с помощью одного типа анализа, что значительно повышает точность диагностики.
«На самом деле, использовать только один тип данных для работы недостаточно. Важно собрать как можно больше информации о пациентах в биобанках и смотреть на проблему комплексно. Это нужно для определения патогенеза заболевания и разработки новых стратегий лечения», — подытоживает Павел Яковлев.