Геном в 3D: что такое упаковка ДНК и как она связана с мутациями

Геном человека — это не просто 3,2 млрд «букв» ДНК (около 800 МБ данных), а сложный 3D-пазл. От того, как ДНК упакована в ядре, зависит, какие гены работают, а какие «спят». Пока учёные только в общих чертах понимают устройство этих механизмов, но технологии вроде 3D-моделирования и ИИ-анализа позволяют разглядеть «оригами из хроматина» и найти связь между укладкой ДНК и болезнями.
Как в клетку умещается двухметровая нить ДНК
Геном — это полный набор генетической информации, который содержится в клетках организма. Речь идёт о совокупности всех генов, которые определяют наследственные признаки и свойства. В геноме хранится информация о строении выполняющих различные функции белков и регуляции их синтеза. Вот почему разбираться в устройстве генетической структуры критически необходимо для понимания многих процессов, происходящих в организме, в том числе причин наследственных заболеваний.
 Искусственный интеллект активно используется в интерпретации геномных данных — например, для предсказания того, к каким последствиям может привести нарушение структуры ДНК
Фото: © Daily insights / Shutterstock / FOTODOM
Искусственный интеллект активно используется в интерпретации геномных данных — например, для предсказания того, к каким последствиям может привести нарушение структуры ДНК
Фото: © Daily insights / Shutterstock / FOTODOM
«Первые шаги в изучении генома совершил Грегор Мендель ещё в XIX веке, скрещивая между собой горох с разными признаками, по которым можно было выявить некоторые законы наследования. Помните те самые задачи из школьного курса генетики? Конечно, на деле эта наука оказалась гораздо сложнее и глубже. Необходимо было найти взаимосвязь между наследованием и проявлением признаков. Фридрих Мишер, исследуя гной, открыл нуклеиновые кислоты и механизмы их взаимодействия. В течение последних 70 лет считалось, что информация хранится и передаётся благодаря структуре ДНК, открытой Джеймсом Уотсоном и Фрэнсисом Криком. Они выяснили, что молекула дезоксирибонуклеиновой кислоты — две спирально закрученные цепи, которые связаны парами оснований: аденин соединяется с тимином, а гуанин — с цитозином. Позже учёные пришли к тому, что геном работает по-разному в разных клетках — и дело всё-таки в его регуляции. Это помогает организму адаптироваться к изменениям окружающей среды, контролировать развитие и работу клеток», — рассказывает младший научный сотрудник Научного центра генетики и наук о жизни Университета «Сириус» Даниил Задорожный.
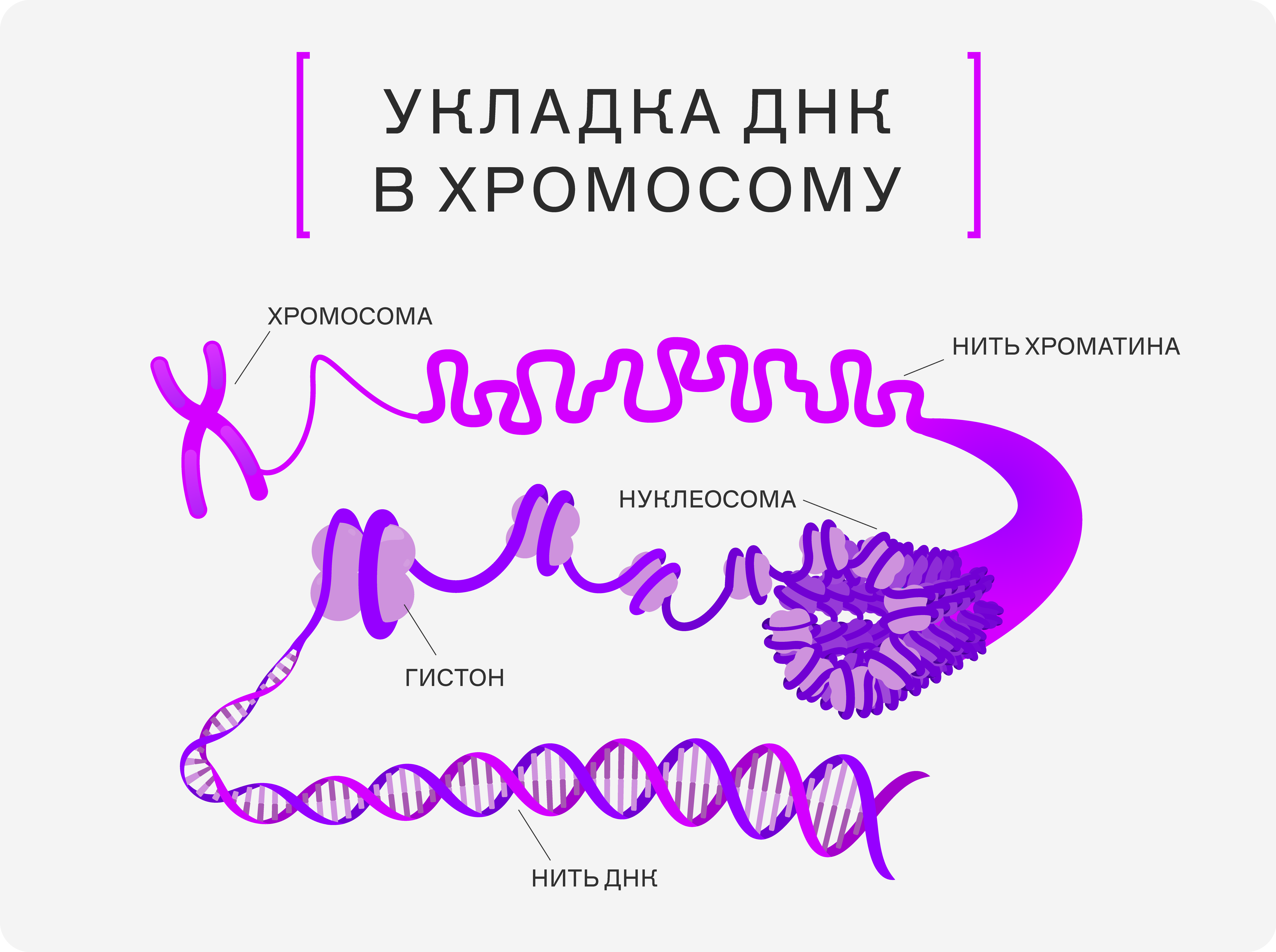
Представьте, что нить дезоксирибонуклеиновой кислоты — это провод наушников, засунутый в карман. Спутавшись, он становится компактнее. В ядре за процесс «запутывания» отвечают белки-гистоны, которые наматывают нить ДНК на себя и сворачивают её в хромосому. ДНК, намотанная на гистон, называется нуклеосомой. Сотни таких структур, соединяясь в нить, укладываются в плечи хромосомы.
Существуют закономерности и правила укладки нити с нуклеосомами в хромосомы, за их соблюдением как раз следят гистоны. В ДНК уже вшиты правила «упаковки»: есть определённые участки, которые должны находиться по краям ядра, тогда как другие должны быть сосредоточены в центре или распределены в определённых зонах ядра (центромеры и теломеры). Это обеспечивает правильное расположение и организацию хромосом, что важно для регуляции работы генов и процессов деления клетки.
«В разных органах человеческого организма находятся разные клетки с одинаковой последовательностью ДНК. Огромные различия в их функционировании обусловлены тем, какие гены в них работают. С этим связаны многие заболевания и особенности развития. Система, которая решает, какие гены будут работать, а какие — нет, очень сложная и малоизученная. Вариантов её работы может быть больше сотни», — поясняет доктор биологических наук и руководитель молодёжной исследовательской группы Научного центра генетики и наук о жизни Университета «Сириус» Вениамин Фишман.
Сейчас биологи буквально вручную разбираются с тем, как работает система регуляции генов: сидят со списком и вычёркивают то, что уже изучили
Вениамин Фишман
В зависимости от того, какую форму принимает нуклеотидная последовательность во время укладки, и того, какие участки нити оказываются ближе друг к другу, регулируется работа разных генов. Подробно изучить структуры, которые принимает ДНК во время этого процесса, можно с помощью методов трёхмерной геномики.
 Белки хроматина формируют петлю ДНК
Изображение: © Лаборатория Cees Dekker, Делфтский технический университет
Белки хроматина формируют петлю ДНК
Изображение: © Лаборатория Cees Dekker, Делфтский технический университет
Как устроена трёхмерная укладка ДНК
В прошлом веке ДНК исследовали с помощью методов микроскопии, что накладывало определённые ограничения. Это всё равно что смотреть футбольный матч из иллюминатора авиалайнера: возможно, разглядеть футбольный стадион и получится, но увидеть футболистов — нет.
«В 2009 году коллеги из США предложили экспериментальный биохимический метод на основе секвенирования, который помог в исследовании контактов участков ДНК друг с другом (какие находятся ближе друг к другу, а какие — дальше). Метод начали масштабировать и применять к разным типам клеток: человеческим, куриным, комариным. Это позволило создать карты взаимодействий между различными участками хроматина и получить на их основе 3D-модели укладки ДНК», — поясняет Вениамин Фишман.
Благодаря новому методу учёные получают таблицы, которые описывают пары участков ДНК и их контакты. Удалось обнаружить важную особенность: контакты образуются не случайно, а формируются определёнными белками. Если взять большую молекулу ДНК и растянуть её, то чем дальше друг от друга будут находиться участки, тем реже они смогут контактировать. Так стало понятно, что когда происходит хромосомная перестройка, меняются и места контактов нуклеотидов. Чаще всего это происходит в местах, где встречаются повторяющиеся участки: клетка ошибается, начиная читать одинаковые элементы, и перескакивает в другое место, что приводит к мутациям.
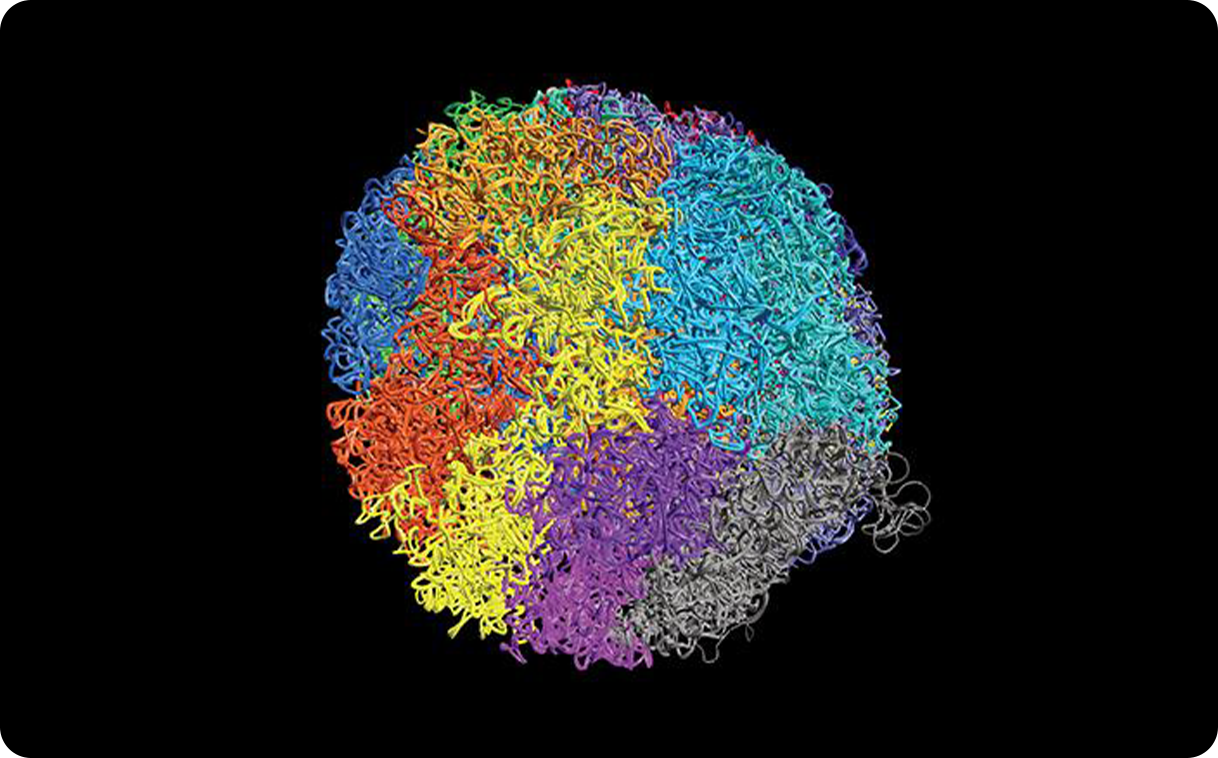 Трёхмерная модель генома представляет собой визуализацию пространственной организации хроматина
Изображение: © Springer Nature
Трёхмерная модель генома представляет собой визуализацию пространственной организации хроматина
Изображение: © Springer Nature
Учёные научились отслеживать эти изменения по секвенированной ДНК пациентов. Увидеть такие участки очень легко — их перемещение влияет на контакты по соседству. Например, если две хромосомы обменялись половинками друг с другом (это называется «реципрокные транслокации»), то изменятся контакты огромных фрагментов длиной в десятки миллионов букв.
Где применяют 3D-структуру генома
Группа Вениамина Фишмана применяет методы анализа контактов ДНК не только для изучения механизмов контроля активности генов, но и в нескольких направлениях медицины, для которых важно исследовать генетические мутации.
Изучение онкозаболеваний. Совместно с Центром детской гематологии, онкологии и иммунологии имени Дмитрия Рогачёва проводят исследования с помощью парафиновых блоков опухолей. Благодаря им находят генетические изменения, спровоцировавшие развитие рака.
Преимплантационная геномная диагностика. При выполнении процедуры ЭКО есть возможность выбрать эмбрион без мутации. На ранней стадии развития у каждого берут биоптат для анализа. Так можно выявить эмбрион без потенциально опасных мутаций. Методы 3D-геномики позволяют сделать этот анализ точнее и выявлять более широкий спектр генетических нарушений.
Диагностика наследственных заболеваний. В Институте цитологии и генетики Новосибирска анализируют геномные данные пациентов с наследственными заболеваниями, что позволяет выявлять специфические изменения в ДНК и определять их влияние на здоровье. Это помогает разрабатывать персонализированные подходы к лечению и профилактике, учитывая уникальные генетические особенности каждого человека.
 При низком разрешении микроскопа точно распознать, как уложена ДНК, практически невозможно
Фото: © Volha_R / Shutterstock / FOTODOM
При низком разрешении микроскопа точно распознать, как уложена ДНК, практически невозможно
Фото: © Volha_R / Shutterstock / FOTODOM
«Наши работы в области 3D-геномики помогают разобраться в том, как нарушения в укладке ДНК влияют на работу генов, но это лишь один из винтиков в сложном механизме регуляции генома. Глобально такие механизмы остаются непонятыми. Мы создали GENA — языковую модель для анализа геномных данных, которая работает примерно как современные нейросетевые методы анализа текстов. Планируем использовать её, чтобы разобраться в том, как регулируется работа конкретного гена в контексте огромного массива биологических данных. Хотим, чтобы модель умела предсказывать, может ли изменение генома в конкретном участке вызывать отклонения в работе определённых генов. Основная сложность заключается в поиске рационального способа обработки большого объёма необходимых для решения этой задачи данных. Как „скормить“ нейросети огромный массив разнородной информации, накопленной биологами за последние десятилетия? Мы пытаемся создать мультимодальную систему, которой можно подать на вход любую биологическую информацию, несмотря на разницу в форматах, а также ошибки и неточности в данных», — рассказывает Вениамин Фишман.
Что может ИИ при работе с ДНК?
- Выяснить, какие механизмы ответственны за развитие патологий: с помощью нейросети можно воспроизвести искусственный генотип с мутациями и определить, действительно ли эти изменения привели к развитию расстройства.
- Определить наличие хромосомных аномалий до пересадки эмбриона.
- Аннотировать некодирующие последовательности генома.
Впрочем, просто загрузить в модель необработанные последовательности нуклеотидов нельзя — система ничего не поймёт. Любую информацию для обучения ИИ нужно сначала подготовить — иначе говоря, собрать датасеты. От их качества сильно зависит результат, объясняет лаборант-исследователь Научного центра генетики и наук о жизни Университета «Сириус» Артём Шадский. По его словам, сейчас команда учёных обучает GENA аннотированию геномных последовательностей.
 GENA может обрабатывать от 4,5 до 36 тыс. пар оснований ДНК
Изображение: из личного архива Артёма Нурисламова
GENA может обрабатывать от 4,5 до 36 тыс. пар оснований ДНК
Изображение: из личного архива Артёма Нурисламова
«Мы хотим, чтобы модель выучила правила, по которым в геноме можно найти гены и их части, и смогла точно размечать такие геномные элементы в новых геномах. Благодаря современным технологиям секвенирования у нас накопились большие наборы геномных данных. Мы собираем их, переводим в понятный для модели формат, акцентируя внимание на значимых для нас вещах, а затем показываем языковой модели. Если нейросеть много раз увидит похожие данные, то сможет разобраться в том, как они устроены, уловить закономерности. Это позволит обученной модели делать предсказания и для других последовательностей, которые она никогда раньше не видела», — поясняет он.
Сегодня активно развивается направление генной терапии для лечения заболеваний, обусловленных генетическими факторами. С помощью искусственного интеллекта в перспективе можно будет разрабатывать генотерапевтические препараты, действующие исключительно в целевых тканях и органах, то есть обладающие высокой специфичностью, предполагает младший научный сотрудник Научного центра генетики и наук о жизни Университета «Сириус» Артём Нурисламов.
«В моём представлении, это будет выглядеть так: мы делаем запрос к ИИ, а он подбирает нуклеотидные последовательности, которые будут функционировать только в тканях и органах, являющихся мишенью для генной терапии. Поэтому исследования в области искусственного интеллекта в будущем могут способствовать улучшению эффективности и специфичности генотерапевтических препаратов», — говорит он.